Tout savoir sur la toxicité médicamenteuse pendant la grossesse
Toxicité médicamenteuse et grossesse : quel impact ?
Durant la grossesse, la femme enceinte et son futur bébé sont solidaires sur le plan physiologique et métabolique.
La grossesse est une période particulière pendant laquelle les médicaments sont en général à éviter SAUF traitement chronique ou aigu prescrit par un médecin.
À l’exception des molécules de poids moléculaire élevé comme l’insuline ou l’héparine, tous les médicaments pris par la mère passent de la circulation maternelle à la circulation fœtale.
Le placenta n’est pas une barrière pour les médicaments.
L’analyse du risque médicamenteux nécessite une bonne connaissance du calendrier du dé Face au risque médicamenteux en cas de grossesse, on distingue 3 situations :
Une femme enceinte ou en âge de procréer nécessite un médicament
Situation plus au moins simple car le médecin a le temps de rassembler les informations pour :
- Choisir un médicament efficace et le moins nocif (rapport bénéfice-risque),
- Etudier la possibilité d’arrêt du médicament au moins pendant la période à risque (exemple AVK/héparine) et la possibilité de diagnostic anténatal.
Une femme enceinte a pris un médicament
La situation la plus fréquente et la plus difficile (exposition en début de grossesse ++) et si les médicaments sont potentiellement dangereux, ou avec peu de données disponibles.
L’attitude face à la grossesse est soit de l’arrêter, soit de la poursuivre.
Après la naissance
Une démarche diagnostique rétrospective entamée devant un enfant porteur de malformations ou d’une autre pathologie de développement intra-utérin et des caractéristiques du médicament.
On ne peut pas parler du risque médicamenteux chez la femme enceinte sans aborder le drame de la THALIDOMIDE qui restera sans nul doute un des faits marquants de l’histoire du médicament.
C’est un cas d’école, tant sur le plan scientifique que sur celui du traitement médiatique et judiciaire.
Une molécule mise sur le marché allemand en 1956 sans toxicité particulière détectée avant la commercialisation, ni d’effets secondaires pour les indications suivantes : traitement de confort pour les nausées matinales des femmes enceintes irritabilité, défaut de concentration, trac, éjaculation précoce, tension menstruelle, troubles de la ménopause, peur des examens, troubles fonctionnels de l’estomac, maladies infectieuses fébriles, anxiété, hyperthyroïdie et tuberculose.
- En 1957 : mise sur le marché dans une cinquantaine de pays, sous une quarantaine de nom différents mais pas en France (lenteur administrative), et très peu USA.
- En 1960 : des cas de neuropathies périphériques signalés.
- En 1961 : Premières publications de tératogenèse.
- Retrait du marché : fin 1961 en Allemagne, 1962 : Espagne, Japon, Irlande et Canada, 1963 Belgique..
- Résultat : naissance de 10 000 à 20 000 nourrissons atteints de graves malformations.
Son effet tératogène semble induit par la capacité du médicament à inhiber l’angiogénèse, en interférant avec le développement des vaisseaux sanguins du fœtus, surtout en cas de prise au cours des 25 à 50 premiers jours de la grossesse.
Les malformations touchaient les membres de manière plus ou moins importante :
- L’amélie : absence de membre chez les « enfants phoque ».
- L’ectromélie : absence de l’extrémité du membre.
- La phocomélie : réduction du segment intermédiaire.
- Anomalies mineures de la main comme la syndactylie.
Et il n’est pas impossible que l’effet tératogène soit transmissible aux enfants des patients atteints.
Les réactions face à cette tragédie étaient :
- Prise de conscience du grand public, des professionnels de santé, des firmes pharmaceutiques, des autorités d’enregistrement…
- Tests toxicité de la reproduction modifiés.
- Contre-indications très nombreuses dans les AMM en cours de grossesse.
- Apparition de l’épidémiologie, de la pharmacovigilance et du CRAT (1975).
- Amélioration de l’information «Grossesse» des AMM.
En France
- Commission de validation (1985)
- Grille d’évaluation médicaments (1991)
- Création du groupe «Reproduction, Grossesse et Allaitement» (1996)
En Europe
- Proposals for a contra-indication statement in pregnancy. Discussion paper CPMP/3833/03.
- Guideline on the Exposure to Medicinal Product during Pregnancy: Need for Post-AuthorisationData (EMEA/CHMP/313666/2005)
- Guideline on risk assessment of medicinal products on human reproduction and lactation: from data to labelling (EMEA/CHMP/203927/2005)
Quelques années plus tard, la découverte fortuite de l’efficacité de la Thalidomide sur l’érythème noueux lépreux offre une seconde chance à la molécule, qui bénéficie d’un regain d’intérêt.
Peu à peu, de nouvelles propriétés lui sont reconnues, notamment anti inflammatoires et immunomodulatrices.
Depuis, la Thalidomide a été réintroduit en thérapeutique, en France notamment, sous le statut d’Autorisation Temporaire d’Utilisation (AT.U.).
Des indications limitées et des modalités de prescription et de dispensation définies garantissent une sécurité d’emploi du médicament malgré son risque tératogène.
Actuellement, le champ d’action de la molécule semble en réelle expansion.
Thalidomide BMS est indiqué, en association au Melphalan et à la Prednisone, pour le traitement de première ligne des patients âgés de plus de 65 ans présentant un myélome multiple non traité ou présentant une contre-indication à la chimiothérapie à haute dose.
Thalidomide BMS doit être prescrit et délivré conformément au Programme de Prévention de la Grossesse de la Thalidomide.

1. Epidémiologie
Le taux des grossesses non planifiées représente environ 33%.
Du fait de l’augmentation de l’âge de la 1ère grossesse augmente on constate une augmentation parallèle des comorbidité et par conséquence le nombre moyen de médicaments prescrits en cours de la grossesse augmente.
En France, près de 90 % des femmes enceintes recevraient au moins une prescription médicamenteuse durant leur grossesse, environ 76 % au premier trimestre, 83 % au deuxième et 84 % au troisième.
Les molécules les plus prescrites en France (50 à 73 % des femmes concernées) 8 à 11 prescriptions :
- Antianémique (Fer, Acide folique).
- Antalgiques (Paracétamol).
- Traitement à visé gastro-entérologique: le Phloroglucinol / les antiacides.
- Les vitamines (vitamine D).
- Anti-infectieux et les antifongiques.
- Sans oublier l’automédication qui représente environ 30%.
La fréquence de base des malformations congénitales dans la population générale, environ 2 % dont :
- 4 à 5% seraient dus à des médicaments ou des toxiques
- 20% à des causes génétiques
- et 65 à 70% de causes inconnues
Le risque «zéro» n’existe pas pour les malformations.
La plus dangereuse des expositions ne provoque jamais 100% de malformations, au pire 20 à 30% (Isotrétinoïne et Thalidomide).
2. Les médicaments tératogènes et les médicaments fœtotoxiques
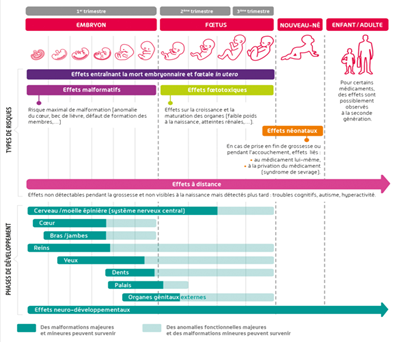
Les risques pour l’enfant ne sont pas les mêmes selon le médicament et la période de la grossesse.
Ci-dessous le calendrier de développement intra-utérin du fœtus.
Selon les médicament on distingue :
a. Les médicaments tératogènes
Le risque est de provoquer des malformations congénitales chez les enfants exposés in utero (2 premiers mois de grossesse).
Médicaments tératogènes avérés à proscrire pendant au moins les 2 premiers mois de grossesse, et si possible au-delà, sauf indication exceptionnelle :
- Acide valproïque (Dépakine®, Dépamide®, Dépakote®, Micropakine®)
- Acitrétine (Soriatane®)
- Diéthystilbestrol (Distilbène®)
- Isotrétinoïne par voie orale (Contracné®, Curacné®, Procuta®) et autres rétinoïdes oraux (alitrétinoïne – Toctino®)
- Misoprostol (Gymiso®, Misoone®)
- Mycophénolate (Cellcept®, Myfortic® )
- Thalidomide
- Testosterone et danazol (Danatrol®) (effet uniquement sur les foetus féminins)
- Antimitotiques : Méthotrexate / Cyclophosphamide
Médicaments tératogènes avérés utilisables en cours de grossesse en l’absence d’alternative thérapeutique plus sûre :
- Lithium (Téralithe®)
- Carbimazole (Néomercazole®, Thyrozol®)
- Anticoagulants oraux (AVK):Warfarine (Coumadine®)/ Acénocoumarol (Sintrom®)/ Fluindione (Préviscan®)
- Certains antiépileptiques : Carbamazépine (Tégrétol®) : Phénobarbital et apparentés (Gardénal®, Primidone®) : Topiramate (Epitomax®)
Médicaments pour lesquels un effet tératogène est fortement suspecté mais n’est pas confirmé à ce jour
- Allopurinol (Zyloric®)
- Cotrimoxazole (Bactrim®)
- Fluconazole à fortes doses (Triflucan®)
- Triméthoprime (Delprim®)
b. Les médicaments fœtotoxiques
Le risque d’effets fœtotoxiques, ou néonatals est irréversibles et plus ou moins sévères, sans effet malformatif à parti du 3ème mois de grossesse.
Anti-inflammatoires non stéroïdiens (AINS) et inhibiteurs sélectifs de Cox2 :
- Ibuprofène (Advil® …)
- Kétoprofène (Profenid® …)
- Nimésulide (Nexen®)
Inhibiteurs de l’enzyme de conversion (IEC) et antagonistes de l’angiotensine 2 :
- Captopril (Lopril® …)
- Enalapril (Renitec® …)
- Losartan (Cozaar® …)
- Médicaments fœtotoxiques utilisables pendant la vie fœtale en l’absence d’alternative thérapeutique plus sûre :
- Antibiotiques de la classe des cyclines.
c. Les effets néonataux
Ces effets sont liés soit au médicament lui-même ou à la privation du médicament (syndrome de sevrage).
Ça concerne tous les traitement chronique de la mère, responsable de sevrage chez l’adulte, est poursuivi jusqu’à l’accouchement ou arrêté brutalement avant l’accouchement (Opiacé, antidépresseur…)
La sévérité ne dépend pas de la posologie maternelle mais de la durée de la prise.
d. Les effets à distance de la naissance
Il s’agit d’effets diagnostiqués chez l’enfant à distance de la naissance (par exemple : troubles cognitifs, troubles du comportement, troubles survenant à la seconde génération…).
Dans ce cas précis le risque concerne toute la grossesse (quel que soit le trimestre).
3. Exposition paternelle
On distingue deux types d’exposition :
a. Exposition pré-conceptionnelle
On constate une pénurie d’informations sur l’exposition paternelle aux médicaments en cas de projet de grossesse, mais la plupart des études disponible présentent des résultats rassurants.
b. Exposition post-conceptionnelle
Pour la plupart des médicaments (ayant un effet tératogène prouvé chez la femme) le préservatif n’est pas nécessaire.
Certaines exceptions: inhibiteurs de la 5-alpha réductase (Finastéride et Dutastéride), le RCP recommande le préservatif même si la concentration dans le sperme est faible que aucun effet tératogène ou toxique n’est attendu.
L’impact limité du sperme sur le risque tératogène peut s’expliquer par le fait que seuls les spermatozoïdes sains sont capables d’engendrer une grossesse. En cas de fécondation avec un spermatozoïde altéré, il est probable que cela conduise à une fausse couche précoce.
Le cycle de développement d’un spermatozoïde jusqu’à l’éjaculation dure moins de 3 mois donc l’exposition à des substances nocives il y a plus de 3 mois sera donc moins significative.
4. La rubrique grossesse du RCP 4.6
Elle est généralement constituée des éléments suivants :
- Les données animales : effets observés au cours des études réalisées chez l’animal.
- Les données cliniques : résumé des données disponibles chez l’Homme, avec le cas échéant description des effets observés ou attendus (effet malformatif, foetotoxique, néonatal, à distance).
- Les niveaux de conduite à tenir : il s’agit d’une évaluation spécifique du risque au cours de la grossesse est effectuée dans le cadre de l’AMM.
Il existe 6 niveaux de conduite à tenir selon le risque qui résultent de l’appréciation et la combinaison des données chez l’animal et chez des données cliniques.
Sans oublier 3 rubriques importantes : contre-indications (4.3), aux mises en gardes spéciales et précautions particulières (4.4), ainsi que dans la rubrique relative aux données de sécurité précliniques (5.3).
| NIVEAUX DE CONDUITE À TENIR |
SIGNIFICATION EN TERMES DE RISQUES |
|
| 1 | Ne doit jamais être utilisé au cours de la grossesse. Les femmes en âge de procréer doivent utiliser une contraception efficace. |
Effet tératogène et foetotoxique démontré dans les données cliniques, quelles que soient les données obtenues chez l’animal. |
| 2 | Ne doit pas être utilisé au cours de la grossesse, sauf si la situation clinique rend le traitement indispensable. Les femmes en âge de procréer doivent utiliser une contraception efficace. |
Effet tératogène ou foetotoxique supposé ou suspecté selon les données cliniques, quelles que soient les données obtenues chez l’animal. |
| 3 | Déconseillé au cours de la grossesse et chez les femmes en âge de procréer n’utilisant pas de contraception efficace. | Aucune ou moins de 300 grossesses exposées au 1er trimestre sans augmentation du risque de malformation selon les données cliniques + effet malformatif ou données insuffisantes dans les études réalisées chez l’animal. |
| 4 | À éviter au cours de la grossesse par mesure de précaution. | Aucune ou moins de 300 grossesses exposées au premier trimestre sans augmentation du risque de malformation selon les données cliniques + absence d’effet malformatif dans les études réalisées chez l’animal.
Entre 300 et 1000 grossesses exposées au premier trimestre sans augmentation du risque de malformation selon les données cliniques + effet malformatif ou données insuffisantes dans les études réalisées chez l’animal. |
| 5 | Utilisation envisageable au cours de la grossesse, si nécessaire. | Entre 300 et 1000 grossesses exposées au premier trimestre sans augmentation du risque de malformation selon les données cliniques + absence d’effet malformatif dans les études réalisées chez l’animal. |
| 6 | Utilisation possible au cours de la grossesse, si nécessaire. | Plus de 1000 grossesses exposées au premier trimestre sans augmentation du risque de malformation, quelles que soient les données chez l’animal. |
5. Pictogrammes
En France depuis 2017, des pictogrammes « femme enceinte » figurent sur les boîtes des médicaments tératogènes ou foetotoxiques.

Le pictogramme actuel est basé sur les informations suivantes :
Risques pour l’enfant à naîtreà prendre en compte :
- Tératogène
- Fœtotoxique
Les médicaments concernés par l’apposition du dispositif d’information :
- Les médicaments disposant d’une AMM en France et qui comportent dans leur résumé des caractéristiques du produit (RCP) des informations indiquant qu’ils sont tératogènes ou fœtotoxiques d’après les études animales ou les données observées chez l’être humain.
- Ainsi, un pictogramme est apposé si un risque d’effet est identifié chez l’animal et ce, même si des données chez l’être humain sont rassurantes, et inversement.
Les éléments du dispositif d’information :
- Un pictogramme avec une femme enceinte.
- Selon l’existence ou non d’alternative thérapeutique, ce pictogramme a la forme d’un triangle danger ou d’un rond barré.
- Une information sur le risque.
- Une conduite à tenir.
Qui décide de l’apposition du pictogramme ?
- L’industriel titulaire de l’AMM.
Un nouveau dispositif est en cours de traitement à l’ANSM depuis janvier 2023 , ce dernier doit informer de quatre risques: le risque tératogène, le risque fœtotoxique, le risque de fausse couche et le risque de troubles neurodéveloppementaux.
6. Conduite à tenir
a. Exemples de médicaments à risque tératogène certain et élevé
| Médicaments | Type de malformations |
Conduite à tenir |
| Thalidomide | Squelette (membres)
Cœur |
Grossesse : contre-indication absolue Femme en âge de procréer :
prescription et surveillance particulière (voir RCP) contraception entre 4 semaines avant et 1 mois (et 3 ans pour l’acitrétine) après arrêt du médicament |
| Lénalidomide | Effet tératogène attendu proche de la thalidomide | |
| Isotrétinoïne Alitrétinoïne
Trétinoïne |
Système nerveux central
Oreille externe Cœur Face |
|
| Acitrétine | Squelette | |
| Mycophénolate | Cœur
Rein Oreille Face Doigts Spina bifida Trachée-œsophage Colobome |
Grossesse : contre-indication absolue Femme en âge de procréer :
prescription et surveillance particulière (voir RCP) contraception entre 4 semaines avant et 6 semaines après l’arrêt du médicament |
| Valproate de sodium | Anomalies de fermeture du tube neural (myéloméningocèle, spina bifida)
Dysmorphie faciale Fente labiale Cœur Troubles graves du développement (30 à 40 %) : diminution du quotient intellectuel global et verbal, autisme |
Grossesse :
contre-indication si valproate maintenu : acide folique (5 mg/j) entre 1 mois avant et 2 mois après la conception ; surveillance prénatale spécialisée Femme en âge de procréer : contre-indication en l’absence de contraception |
b. Exemples de médicaments à risque tératogène faible, ou mal quantifié, nécessitant un diagnostic anténatal
| Médicaments | Type de malformations |
Conduite à tenir |
| Lithium | Cœur et gros vaisseaux (dont communication interventriculaire ou interauriculaire ≤ 5 %, maladie d’Ebstein < 0,1 %) | Si possible arrêt jusqu’au 56e jour
Échographie axée sur le cœur ≥ 18 SA |
| Carbamazépine (risque malformatif moins établi pour oxcarbazépine) | Anomalies de fermeture du tube neural (0,5-1 %)
Fente labiale Cœur |
Acide folique (5 mg/j) entre 1 mois avant et 2 mois après la conception
Échographie axée sur le tube neural et la face |
| Phénytoïne | Crâniofaciales et phalanges (1,5 %) | Échographie axée sur les organes cibles |
| Topiramate | Fente labio-palatine
Hypospadias Microcéphalie (8,2 %) Troubles neurodéveloppementaux, déficiences intellectuelles (1 à 8 %) |
Contre-indication chez la femme enceinte ou en âge de procréer sans contraception |
| Prégabaline | Malformations (système nerveux, œil, système urinaire, organes génitaux, fentes oro-faciales) | Ne pas utiliser chez la femme enceinte ou en âge de procréer sans contraception |
| AVK | Os du nez (hypoplasie ou absence) et des phalanges (hypoplasie)
Ponctuation des épiphyses Perte embryonnaire ou fœtale |
Contre-indication pendant la grossesse
Femme en âge de procréer : contraception Échographie axée sur massif facial, squelette, cerveau |
| Méthotrexate | Membres, système nerveux central, appareil cardiovasculaire, crâniofaciale | Contre-indication pendant la grossesse
Femme en âge de procréer : contraception avant, pendant et 3 mois après arrêt du traitement |
| Acétazolamide | Crâniofaciale et cardiaque | Contre-indication pendant la grossesse
Femme en âge de procréer : contraception |
| Triméthoprime ou sulfaméthoxazole/triméthoprime | Suspicion de malformations : fente palatine
Atteintes du tube neural et du cœur |
Ne pas utiliser au cours du 1er trimestre, ni en cas de désir de grossesse |
| Fingolimod | Cœur
Rein Anomalies musculo-squelettiques |
Contre-indication pendant la grossesse
Femme en âge de procréer : contraception avant, pendant et 2 mois après arrêt du traitement |
| Chloroquine | Suspicion de malformation oculaire | Ne pas utiliser pendant la grossesse
Femme en âge de procréer : contraception pendant et jusqu’à 8 mois après l’arrêt du médicament |
| Carbimazole | Malformation : face, paroi abdominale, aplasia cutis | Contre-indication pendant le 1er trimestre |
c. Exemples de médicaments à risque fœtal
|
Médicaments |
Manifestations fœtales ou néonatales |
Conduite à tenir |
| AINS (y compris les anti-COX 2) | Toxicité rénale et cardiaque dès 12 semaines d’aménorrhée | Contre-indication aux 2e et 3e trimestres de grossesse
Prévention de l’automédication Avant 5 mois : éviter si possible d’utiliser un AINS en chronique Après 5 mois (24 SA) : tous les AINS sont contre-indiqués même en prise ponctuelle y compris ceux utilisés comme antalgiques (ibuprofène : Advil®, Nurofen®…) quelle que soit la voie, même cutanée(sauf oculaire car quantités minimes) |
| Inhibiteurs de l’enzyme de conversion (IEC)Sartans (ARA II) | Toxicité rénale dès 12 semaines d’aménorrhée | Contre-indication aux 2e et 3e trimestres de grossesse |
| Acétazolamide | Anomalies hydroélectrolytiques du volume de liquide amniotique et RCIU | Ne pas utiliser aux 2e et 3e trimestres, sauf nécessité absolue |
| AVK | Risque accru de mortalité fœtale, hémorragies fœtales et/ou néonatales | Contre-indication pendant la grossesse
Si exceptionnelle utilisation des AVK pendant la grossesse (valve cardiaque à risque thromboembolique élevé) : substitution par héparine à partir de la 36e semaine d’aménorrhée |
| Isotrétinoïne orale | Risque potentiel neurodéveloppemental | Contre-indication pendant toute la grossesse et chez la femme en âge de procréer sans contraception |
d. Exemples de médicaments à risque de manifestations chez le nouveau-né
|
Médicaments |
Manifestations fœtales ou néonatales les plus fréquentes |
Conduite à tenir |
| Inducteurs enzymatiques :carbamazépine
oxcarbazépine phénobarbital phénytoïne rifampicine |
Syndrome hémorragique précoce (déficit en vitamine K)
Anomalie phosphocalcique (déficit en vitamine D) Sédation, difficultés de succion, hypotonie (avec les antiépileptiques) |
Mère : vitamine K1, 10 à 20 mg par jour pendant les 15 jours précédant l’accouchement ; vitamine D2 : 1 000 U par jour pendant le dernier trimestre Nouveau-né : vitamine K1 0,5 à 1 mg IM ou IV, surveillance neurologique si antiépileptique |
| Bêtabloquants | Hypoglycémie
Bradycardie Insuffisance cardiaque Hypotension |
Nouveau-né : surveillance de glycémie, pression artérielle et fréquence cardiaque |
| Benzodiazépines | Troubles de la succion, somnolence, hypotonie, dépression respiratoire, apnée
Rarement : syndrome de sevrage |
Mère : préférer si possible l’oxazépam, à demi-vie intermédiaire Nouveau-né : surveillance de la respiration |
7. Conclusion
Lutter contre l’automédication et la prescription intempestive et erronée des médicaments.
Le désastre de la Thalidomide responsable des dégâts irréparables et détruit des milliers de vies a fait une révolution dans les démarches d’approbation des médicaments à l’international.
Renforcer la sensibilisation pré-conceptionnelle afin d’éviter les grossesses exposées par mégarde.
Prendre en compte la demi-vie d’élimination des produits pour apprécier le délai avant conception : 5 demi-vies plus un cycle d’ovogenèse ou de spermatogenèse.
Renforcer le suivi des grossesses exposées :
- Préparer sa grossesse avec son médecin ou sa sage-femme.
- Informer tous les professionnels de santé consultés de sa grossesse ou de son projet de grossesse.
- Ne pas arrêter seule son traitement.
Mise à jour continue de La rubrique 4.6 du RCP avec les données cliniques.
Accroitre la qualité d’analyse des données recueillies : effets malformatifs, mais aussi fœtaux et néonatals pour une meilleure évaluation de la balance bénéfice/risque.
Pour plus d’information :
- Centre régional de pharmacovigilance (CRPV) dont vous dépendez.
- Centre de référence sur les agents tératogènes (CRAT).