Focus métier – Chargé d’Affaires Réglementaires
Chargé d’Affaires Réglementaires, c’est quoi ?
Ce domaine est plutôt vaste et regroupe différents corps de métiers chargés d’obtenir et de maintenir une AMM (Autorisation de Mise sur le Marché). Cela, pour un médicament, dans une région ou un pays donné.
Afin d’obtenir cette AMM, il est nécessaire de soumettre un document appelé CTD (Common Technical Document) aux autorités de santé de la région ou du pays concerné. Le CTD est structuré de la façon suivante :
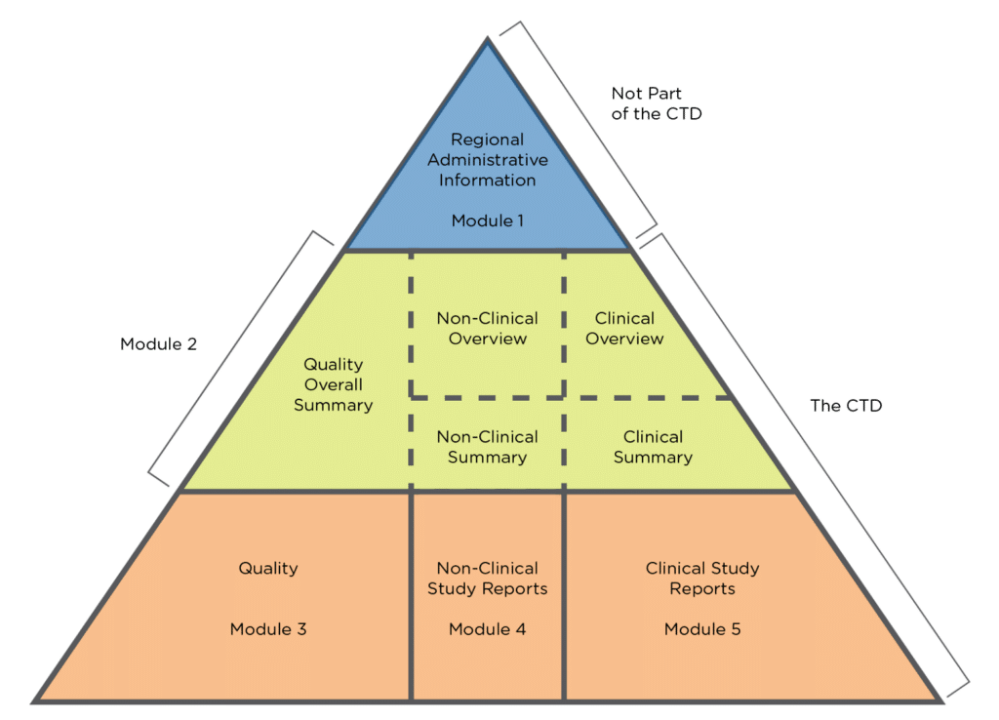
Les Chargés d’Affaires Réglementaires sont responsables de la rédaction et de la mise à jour des modules 1 ; 2 (partie qualité) et 3 sur la pyramide. Les parties 4 et 5, étant sous la responsabilité des Affaires Médicales et de la Pharmacovigilance.
Et au quotidien, le Chargé d’Affaires Réglementaires ?
Lorsque que l’entreprise va décider de vendre un produit dans une région ou un pays, 2 options s’offrent à elle.
S’il s’agit d’un nouveau médicament, le dossier est à rédiger dans son intégralité. Pour cela, nous allons solliciter tous les corps de métier, des premières étapes de recherche de la molécule, jusqu’à la production du produit fini. Notre travail est ensuite de rédiger, compiler et mettre en forme le dossier. Un fois complet, nous allons l’envoyer aux autorités de santé, qui vont ensuite nous challenger sur le dossier. A la suite de ces échanges, les autorités seront en mesure d’accepter ou de refuser le dossier. Si ce dernier est accepté, nous obtenons un numéro d’AMM. Il sera valable plus ou moins longtemps, en fonction des choix de l’entreprise ou des pays.
Dans le cas ou le médicament est déjà commercialisé, il s’agit d’une modification du dossier d’AMM. Dans un premier temps, nous allons donc évaluer cette variation : les impacts sur les différentes parties du dossier, la gravité de cette variation selon les réglementations du pays ou de la région, ainsi que les requis (documents à envoyer en plus de la partie du dossier mise à jour). Ensuite, le principe est le même que pour les nouveaux enregistrements : un jeu de questions / réponses avec les autorités qui acceptent ou refusent la variation.